Карциномът на гърдата (КГ) е най-честото онкологично заболяване сред жените. През 2020 г. в света са регистрирани над 2 300 000 нови случая, а близо 685 000 души (мъже и жени) са починали от тази болест. В България и като цяло в Източна Европа карциномните болести не са с толкова висока честота, колкото в западните страни, с малко изключения (като карцинома на маточната шийка). Въпреки това всяка година в България се диагностицират около 4000 нови случая и 1400 души умират от КГ. Прави впечатление и друго. Преживяемостта на нашите болни е традиционно по-ниска (5-годишната преживяемост е с поне 10% по-ниска) от средната за Европа.

Едно и пет -годишна преживяемост на пациентите с рак на гърдата по възрастова група и регион (2000-2007) . Източник: ECIS. Няма налична информация за Гърция, Кипър, великобритания, Унгария, Люлсембург и Румъния Dafni U, Tsourti Z, Alatsathianos I. Breast Cancer Statistics in the European Union: Incidence and Survival across European Countries. Breast Care (Basel). 2019 Dec;14(6):344-353. doi: 10.1159/000503219. Epub 2019 Oct 8. PMID: 31933579; PMCID: PMC6940474.
А това всъщност никак не е малко. Особено впечатляваща е разликата в преживяемостта на болните, диагностицирани в метастатичен стадий, при които до скоро преживяемостта беше близо два пъти по-кратка от докладваната в други страни за същия период от време. А дали тази тенденция продължава и днес, може би няма и да разберем, тъй като данните на Националния раков регистър са все по-малко. И докато всичко това е суха статистика, макар и звучаща ужасно, реалните проблеми в грижата за тези болни са очевидни.
Дали лошата статистика идва от лоша регистрация на болните и проблемния Национален раков регистър, който е все по-малко национален, а видът на събираната информация не се е променил в последните 10 години?
Дали пък причината е в липсата на скринингова програма за КГ в България, липсата на национална програма за наследствените карциноми и като цяло липса на обучение на хората и обществото, поради което нашите болни се диагностицират в един по-напреднал стадий?
А може би причината е в липсата на специализирани центрове за лечение на тази болест? В колко от КОЦ-овете и УМБАЛ-ите в България има отделения, специализирани в лечението на КГ, и колко специализирани са те всъщност? Колко от нас (образни диагностици, хирурзи, патолози, онколози и лъчетерапевти) са преминали специализирано обучение за болести на гърдата, а не са се учили основно от собствените си грешки? Тази тема боли и няма как да се хареса на никого.

И всички тези причини са съвсем близки до нас, а решенията им много по-достъпни от въпроса имаме ли достъп до съвременните подходи за лечение, за да ги прилагаме ежедневно.
А специално в хирургията достъп имаме. В България могат да се внасят маркери за маркиране на лезиите на гърдата, могат да се внасят и гама-сонди, както и технеций за биопсиране на сентинелни лимфни възли, както и по-модерни технологии като индоцианиново зелено, за което не е необходимо дори наличието на Отделение по нуклеарна медицина в съответната болница. Съвременните европейски препоръки за лечение на КГ са свободно достъпни за четене от всеки лекар и от всеки пациент.

Кръгъл маркер за тумори на гърда
Но всички ние сякаш не се затормозяваме излишно. Предпочитаме да разчитаме на собствения си опит вместо на световния и резултатите от това са видни – по-кратка преживяемост и влошено качество на живот за сметка на …. нищо. Няма хирург, който да е оперирал толкова пациентки (по-конкретно 1851) с КГ и да ги е проследил 20 години, колкото в проучването NSABP B-04, което доказва, че извършването на мастектомия носи същите онкологични рискове, както и извършването на органосъхраняваща операция с последваща лъчетерапия. Резултатите от това проучване са публикувани преди вече 20 години в New England Journal of Medicine и дори днес има хирурзи, които оспорват приложението на органосъхраняващи операции. Нито пък някой в България е проследил 10 години 856 пациентки (както в проучването ACOSOG Z0011) с органосъхраняваща операция, само 1 или 2 позитивни лимфни възела и проведена лъче- и системна терапия, за да установи, че извършването на аксиларна дисекция при тези пациенти, може най-вече да влоши качеството на живот, без да намали риска от рецидив или смърт. А за да кажем колко ангажирана е аксилата, дали провеждането на ЯМР или ехография от специалист е стандартна практика? Интересни са резултатите и от проучването AMAROS, включващо 1425 пациенти с един или два позитивни лимфни възела, проследени вече повече от 10 години и разделени в две групи – с последваща аксиларна дисекция или с последваща лъчетерапия. В групата с последваща лъчетерапия рецидивите са 11, а в групата с аксиларна дисекция – 7, и тази разлика, разбира се, не е статистически значима. У нас за сметка на това най-често казваме „Изчистил/а съм всичко перфектно, съжалявам за лимфедема!“.
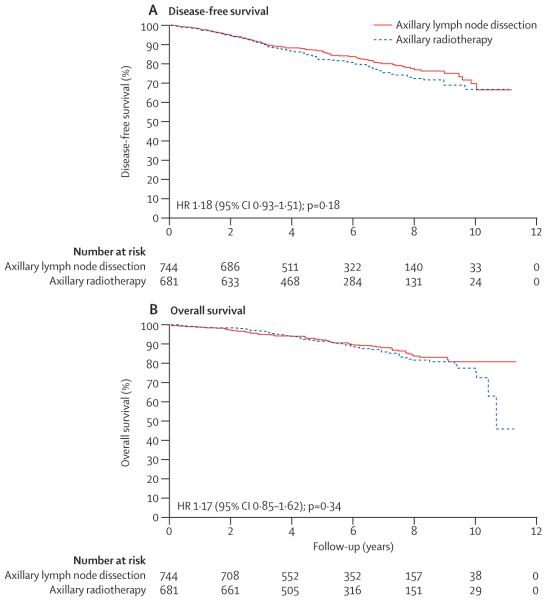
Donker, Mila et al. “Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial.” The Lancet. Oncology vol. 15,12 (2014): 1303-10. doi:10.1016/S1470-2045(14)70460-7
Всичко това, разбира се, не означава, че от утре мастектомиите са в историята или пък аксиларните дисекции. Означава само, че всичко си има своето място, което пък се променя постоянно.
Накрая, не мога да не отбележа един метаанализ, публикуван през 2010 г., обхващащ 21 проучвания и 14 571 болни с 1026 локални рецидива, който доказва, че дебелината на резекционната линия не е от съществено значение за риска от локален рецидив и разликата в отстоянието от тумора на 1 mm, 2 mm или 5 mm в здраво не носи допълнителна полза за локалния контрол на болестта.
Всичко това и по-конкретно крещящата нужда от по-добра грижа и по-добри данни и повече възможности както за пациентите, така и за медицинските специалисти ме кара ежедневно и постоянно да разгласям и повтарям тези факти. И дано това доведе до промяната от която имаме нужда.