Елица Валериева (Отделение по акушерство и гинекология, Медицински комплекс „Д-р Щерев“ – София)
Мариела Василева-Славева (Отделение по хирургия, Медицински комплекс „Д-р Щерев“ – София)
Резюме:
През 2017 г. новите случаи на карцином на гърдата (КГ) в България са 3535, а на карцином на яйчника (КЯ) 707. Годишно в България между 360 и 540 жени новодиагностицирани с КГ, както и около 230 пациентки с КЯ имат вероятно генетична предизпозиция и те, както и техните семейства, имат нужда от медико-генетична консултация. За да можем да достигнем до тях, имаме нужда от по-стриктно събиране и анализиране на данните, както и по-голяма информираност, както сред лекарите, така и сред пациентите по отношение на съвременните възможности за диагностика и терапия при високорисковите групи.
В съвременния свят нито една жена с известна генетична мутация не бива да умира вследствие на рак. Всяка диагноза карцином на гърдата и яйчника при пациенти с BRCA 1 и 2 мутация е пропусната възможност за превенция. През 2018 г. Американската асоциация по храните и лекарствата (Food and Drug Administration, FDA) одобрява първия PARB инхибитор – оlaparib като първа линия монотерапия или в комбинация с bevacizumab за лечение на авансирал карцином на яйчниците и метастатичен HER2 негативен карцином на гърдата. Индикацията е за пациенти, при които има установена мутация в BRCA1 или BRCA2 гените. През 2021 г. са публикувани и резултатите от адювантното приложение на olaparib при ранен КГ, които доказват, че той значително подобрява преживяемостта без болест (ПББ) и в тази група носители на BRCA1 и 2 мутации.
Въведение
Крациномът на гърдата (КГ) е най-честото злокачествено заболяване сред жените с около 2,3 млн. нови случая и 685 хил. смъртни случая в световен мащаб всяка година. Карциномът на яйчника (КЯ) е също изключително социално значимо заболяване – на първо място по причина за смърт в следствие на злокачествено гинекологично заболяване и пета най-честа причина за смърт от злокачествени заболявания в Европа. Годишно в света близо 314 хил. пациентки биват диагностицирани, а 207 хил. умират с тази диагноза (1). Доживотният риск от развитие на КГ в общата популация е 12%, с пикова честота във възрастовата група 50-65 години (2). КЯ носи 1,7% доживотен риск с пикова честота във възрастовата група 45 до 65 години (3, 4). Важно е да се подчертае, че диагнозата карцином на яйчника в 70% от случаите се поставя в напреднал стадий, което е и една от причините за високата смъртност (5).
Още през 80-те години на миналия век, когато водеща теорията за възникване на злокачествените заболявания е била вирусната теория, започва да се коментира вероятна генетична предразположеност към неоплазми. По това време правело силно впечатление високата честота на онкологична забоялвания в някои семейства. Правело впечатление и асоциираността на някои тумори, каквито са тези на гърда и яйчник. Сега, след разкриване на конкретни гени и механизми на тяхното унаследяване, говорим за наследствени ракови синдроми. В България през 2017 г. в Националния раков регистър са регистрирани 3535 нови случая на КГ и 707 нови случая на КЯ. Годишно в България между 360 и 540 жени новодиагностицирани с КГ, както и около 230 пациентки с КЯ са най-вероятно носители на наследствена предизпозиция за развитие на болестта (6).
Колко голям проблем е проблемът за наследствения карцином на гърдата и яйчника?
В около 10 до 15% от случаите на рак на гърдата могат да се открият мутации, които са унаследени от родителите. В до 60% от наследствените случаи на КГ се установяват мутации в BRCА1 и BRCA2 гените (7). Наличието на мутация в BRCA1 носи кумулативен риск от 72% за развитие на КГ до 80 годишна възраст, а BRCA2 – 69% до 80-годишна възраст. Кумулативният риск за развитие на контралатерален КГ до 20 години след поставяне на инициалната диагноза е 40% за BRCA1 и 26% за BRCA2 (7). При КЯ в около 30-40% от случаите става дума за наследствен карцином, като основна причина е синдромът на наследствения карцином на гърда и яйчник (до 70-80%). Кумулативният риск от рак на яйчника при носители на мутация в BRCA1 e 44% и 17% при носители в BRCA2 до 80-годишна възраст. Обичайно КЯ в следствие на BRCA2 мутация се проявяват с около 10 години по-късно в сравнение с тези при BRCA1 мутации. Типичният наследствен яйчников карцином е high grade ovarian carcinoma, като обичайно диагнозата се поставя в авансирал стадий (7, 8).
Както показва и името му, синдромът на наследствения карцином на гърда и яйчник (НКГЯ) има две различни проявления, които могат да се установят при различни пациенти или дори при един и същи пациент. Причина за него са мутации в гените BRCA1 и BRCA2. И двата гена са тумор-супресорни гени, мутации в които се явяват първи геномен удар в раковите фамилии и водят до повишен онкологичен риск. BRCA1 е ген разположен в дългото рамо на 17-та хромозома. През 1990 г. Мери-Клеър Кинг за първи път описва мутации в този ген, водещи доповишен риск от развитие на КГ (9). През 1994 г. Ричард Уустер, Сюзан Нойхаузен и сътрудници описват втори подобен ген в дългото рамо на 13-та хромозома, който наричат BRCA2 (10). Мутациите в BRCA1 и 2 гените са най-чести, крият най-висок онкологичен риск и имат висока пенетрантност. Понастоящем са известни над 2000 патологични мутации в тези гени (11). С напредването на новите технологии и развитието на секвенирането от ново поколение започва изследването не само на отделни гени, но и тестването на цели панели от гени. Така, макар и по-рядко, в случаите на наследствен рак на гърдата могат да се открият мутации в ATM, CDH1, CHEK2, PALB2, PTEN, STK11, TP53, NBN, RAD51C, RAD51D, BRIP1, BARD1 гените и други (12). Следващи по честота след BRCA1 и BRCA2 гените са мутациите в CHEK2. При болни с рак на гърдата мутации в CHEK2 се откриват при 1.5% от случаите, а честотата сред общата популация е 0,65% (13). Според други автори риска от развитие на рак на гърдата при носители на мутации в PALB2 гените при жени под 40 години е 8-9 пъти по-висок от риска при общата популация; при жени между 40 и 60 е 6-8 пъти по висок; а при жени над 60 години е 5 пъти по-висок. Така той може да е сравним с риска при носители на мутации в BRCA1 и BRCA2 гените (14). Профилактични мерки могат да се предприемат и при носители на мурации в CDH1, PALB2, CHEK2 и STK11, но лечение за сега е налично само за пациентите със BRCA1 или 2 мутация (15). За това и съвременните европейски препоръки за диагностика и лечение на наследтсвени карциноми на гърдата и яйчниците са насочени най-вече към ностелите на BRCA1 и 2 (16).
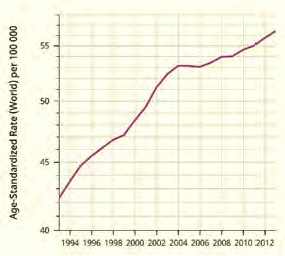
Фигура 1. Тенденции във възраст-стандартизирана заболеваемост от карцинов на гърдата в България от 1994 до 2012 г.
Индикации за изследване на генетична предразположеност
Американската мрежа за изследване на рака (National Comprehensive Cancer Network, NCCN) публикува клиничните индикации за изследване на пациенти със съмнение за наследствен рак на гърдата.
Такива са всички хора:
1. кръвни родственици на хора с доказани мутации в някой от гените, свързани с карцином – BRCA1, BRC2, CDH1, PALB2, PTEN, TP53 и други;
2. индивиди, отговарящи на критериите, които са били негативни след изследване с предишни по-ограничени тестове;
3. индивиди, отговарящи на критериите на синдрома на Li-Fraumeni, Cowden или Lynch.
Изследване може да се обмисли при индивиди, които са част от субетническата група евреи ашкенази, без да са налице други рискови фактори.
При пациенти с доказан КГ, критериите за генетично изследване включват:
1. болни с анамнеза за рак на гърдата и поне едно от следните условия:
(1) диагностициран преди 45-годишна възраст;
(2) диагностициран между 46 и 50-годишна възраст, но:
- с неясна фамилна история;
- втори карцином, независимо от възрастта на диагноза;
- повече от един кръвен роднина с карцином на гърдата, яйчниците, панкреаса или простатата.
(3) диагностициран след 51-годишна възраст:
- ако има поне един кръвен роднина с едно от следните условия:
а) жена, диагностицирана с КГ преди 50 или мъж с КГ, независимо от възрастта;
б) карцином на яйчника, панкреаса или високорисков карцином на простата, независимо от възрастта;
- повече от 3 диагнози на КГ при пациента и/или негови близки роднини;
- повече от двама роднини с КГ и карцином на простатата, независимо от възрастта на диагноза.
(4) болни на всяка възраст, при които:
- е необходимо да се вземе решение за прилагане на PARP инхибитори в лечението на метастатичен КГ;
- е необходимо да се вземе решение за адювантно лечение с olaparib при ранен, HER2 негативен КГ;
- карциномът е тройно-негативен;
- карциномът е лобуларен и пациентът има фамилна анамнеза за дифузен карцином карцином на стомаха;
- е диагностициран КГ при мъж;
- имат поне един роднина мъж, диагностициран с КГ.
При индивиди с фамилна история, генетично изследване може да се обмисли в следните ситуации:
1. индивиди със или без рак на гърдата, които са първа или втора линия на някой отговарящ на някое от горните условия;
2. ако този, който отговаря на горе-описаните критерии е с рак на панкреаса или простата-клинична индикация за генетично изследване имат само роднините първа линия;
3. индивиди с или без доказан рак на гърдата, които не отговарят на горните критерии, но имат над 5% вероятност да са носители на BRCA патогенна мутация, базирано на предиктивни модели (Tyrer-Cuzick, BRCAPro, CanRisk) (17).
Методи за превенция
На първо място превенцията включва скринингови програми за вискорисковите групи (пациенти, носители на мутация за наследствен карцином на гърдата и яйчниците). Според препоръките на ESMO (16) и NCCN (17) във високо рисковите групи пациентите трябва:
1. от 18-годишна възраст да се самопреглеждат и да известяват наблюдаващия лекар при настъпване на промяна в състоянието на гърдите;
2. от 25-годишна възраст трябва да се започне с редовни профилактични прегледи на всеки 6 до 12 месеца;
3. от 29 до 75 години се препоръчва да се извършва
2 пъти годишно ядрено-магнитен резонанс (ЯМР) или поне веднъж годишно;
4. допустимо е във възрастовата група 30 до 75 години вместо ЯМР да се извършва мамография;
5. след 75-годишна възраст скринингът трябва да бъде индивидуализиран спрямо конкретната клинична картина и фамилна анамнеза;
6. при пациенти, силно суспектни за мутации в BRCA 1/2, при които не е извършена двустранна мастектомия проследяването би следвало да е като при скрининг във високо рисковите групи.
Същите наръчници подчертават, че до момента не съществува ефективен скрининг за рак на яйчника. Правят се проучвания с възможни алгоритми за проследяване и скрининг, като например калкулаторът ROCA: Risk of Оvarian Cancer Algorithm, но и той не е доказал достатъчна чувствителност и специфичност (18).
Друг подход са операциите за намаляване на онкологичния риск. Билатералната мастектомия намалява онкологичния риск в до 95% от случаите (19), което свежда риска от рак на гърдата до стойности по-ниски и от тези в общата популация; намалява се специфичната за рак на гърдата смъртност с до 90% (20), и увеличава общата преживяемост. Билатералната салпингоофоректомия намалява с до 80% риска от овариален карцином, рак на маточните тръби, както и първичен перитонеален карцином (21); двустранното профилактично отстраняване на маточните тръби и яйчниците намалява с до 50% случаите на рак на гърдата във високорисковите групи; също така намалява общата смъртност в следствие на рак с до 77% (22).
Лечение на пациенти с рак на гърдата и яйчниците, носители на мутация в BRCA1 и 2 гените
PARP инхибиторите са сред първите средства, показали ефективност в поддържащата терапия на авансиралия карцином на яйчника. Антитуморният ефект на PARP инхибиторите разчита на работата на дефектен ДНК поправящ механизъм в раковите клетки с нефункционираща хомоложна рекомбинация. Olaparib е PARP инхибитор, които има няколко одобрени индикции за приложение при КЯ и в няколко проучвания е демонстрирал удължаване на ПББ (23).
През 2021 г. са публикувани резултати от проучването SOLO1 (NCT01844986), което е рандомизирано, двойно-сляпо, плацебо-контролирано фаза 3, мултицентрично проучване, включващи BRCA1 или 2 позитивни новодиагностицирани авансирали нискодиференцирани серозни или ендометроидни авариални карциноми, с пълен или частичен отговор на платино-базирана химиотерапия. Пациентите са рандомизирани да получат olaparib 300 mg два пъти на ден или плацебо таблетки за 2 години. В проучването са включени 260 пациенти, които са проследени средно около 5 години. Медианата на преживяемостта без болест е 56 месеца в групата пациенти, получили olaparib спрямо 13,8 месеца в групата пациенти, получили плацебо таблетки (24). Тази голяма разлика в преживяемостта води и до по-широкото изследване на мутациите в BRCA1 и 2 гените при овариален карцином.
През 2013 г. започва прочуването OlympiAD (NCT02000622), при което се сравнява ефикасността и безопсността на olaparib с ефикасността на стандартна терапия – химиотерапия с един агент по избор на лекуващия лекар сред пациентите с HER2 негативен метастатичен карцином на гърда, носители на мутация в BRCA гените. В проучването се включват, както пациенти с хормон позитивни тумори, така и тройно-негативни такива, при които са проведени не повече от две линии химиотерапия за лечение на метастатична болест с антрациклини и таксани. Пациентите с хормон-позитивни тумори са получили поне една ендокринна терапия преди включването в проучването. Предишно лечение с платина-съдържащи агенти е допустимо, ако са минали повече от 12 месеца от последната доза и няма доказателства за прогресия на болестта на фона на тази терапия. Проучването е рандомизирано контролирано мултицентрично фаза 3. Пациентите са насочени да получат таблетки olaparib 300 mg два пъти дневно или стандартна терапия с един от следните агенти- capecitabine, eribulin mesylate или vinorelbine, до прогресия или достигане на неприемлива токсичност. Проучването включва 302 пациенти, от които 205 са получили olaparib. Медианата на ПББ е 7,8 месеца в групата на пациентите, получили olaparib спрямо 3,8 месеца в групата на пациентите, получили стандартна терапия. На 12тия месец от рандомизцията 25,9% от пациентите в групата на olaparib и едва 15,0% от пациентите в контролната група са свободни от прогресия или смърт (25).
През 2021 г. са публикувани резултатите от проучването OlympiA (NCT02032823), което приложението на olaparib като адювантна терапия при ранен карцином на гърдата. Проучването е фаза 3, двойно-сляпо, рандомизирано, включващо пациенти с HER2 негативен ранен КГ, с налична мутация в BRCA1 или BRCA2 гените и висок риск, които са получили локално лечение и адювантна или неоадювантна химиотерапия. Пациентите са рандомизирани да получат 1 година olaparib или плацебо. Проучването включва 1836 пациенти. При средно проследяване от 2,5 години, 3-годишната преживяемост без инвазивна болест в групата на пациентите, получили olaparib е 85,9%, а в контролната група е 77,1%. 3-годишната преживяемост без далечни метастази е 87,5% в групата на olaparib и 80,4% в плацебо групата. Страничните ефекти от приложението на olaparib не са по-различни от очакваното, без да са регистрирани по-тежки такива (26).
Заключение
В съвременния свят нито една жена с известна генетична мутация не бива да умира вследствие на рак. Всяка диагноза карцином на гърдата и яйчника при пациенти с BRCA 1 и 2 мутация е пропусната възможност за превенция. Необходимо е спешно въвеждане на скринингови програми, особено при пациентите от високорисковите групи.
До момента PARP инхибиторите са единствените лекарства, насочени за лечение на пациенти с карцином на гърдата и яйчника и наследствена мутация и единствените такива мутации са тези в BRCA1 и 2 гените. Индикациите за приложение на първия PARP инхибитор – olaparib се разширяват и днес, той се прилага и като част от адювантното лечение при ранен КГ.
Библиография:
1. WHO. Globocan 2020. International Agency for research. 2020;419.
2. Feuer EJ, Wun LM, Boring CC, Flanders WD, Timmel MJ, Tong T. The lifetime risk of developing breast cancer. Journal of the National Cancer Institute. 1993;85(11).
3. National Cancer Institute. Ovarian Cancer – Cancer Stat Facts. Surveillance, Epidemiology, and End Results Program. 2015.
4. Boyle P, Ferlay J. Cancer incidence and mortality in Europe, 2004. Annals of Oncology. 2005;16(3).
5. Gockley A, Melamed A, Bregar AJ, Clemmer JT, Birrer M, Schorge JO, et al. Outcomes of women with high-grade and low-grade advanced-stage serous epithelial ovarian cancer. Obstetrics and Gynecology. 2017;129(3).
6. Bulgarian National Cancer Registry. Cancer Incidence in Bulgaria, 2016 & 2017. 2020;XXVI.
7. Kuchenbaecker KB, Hopper JL, Barnes DR, Phillips KA, Mooij TM, Roos-Blom MJ, et al. Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers. JAMA – Journal of the American Medical Association. 2017;317(23).
8. Eoh KJ, Kim JE, Park HS, Lee ST, Park JS, Han JW, et al. Detection of germline mutations in patients with epithelial ovarian cancer using multi-gene panels: Beyond BRCA1/2. Cancer Research and Treatment. 2018;50(3).
9. King MC. “The race” to clone BRCA1. Vol. 343, Science. 2014.
10. Wooster R, Bignell G, Lancaster J, Swift S, Seal S, Mangion J, et al. Identification of the breast cancer susceptibility gene BRCA2. Nature. 1995;378(6559).
11. Rizzolo P, Silvestri V, Falchetti M, Ottini L. Inherited and acquired alterations in development of breast cancer. Application of Clinical Genetics. 2011;4.
12. Wunderle M, Olmes G, Nabieva N, et al. Risk, Prediction and Prevention of Hereditary Breast Cancer – Large-Scale Genomic Studies in Times of Big and Smart Data. Geburtshilfe Frauenheilkd. 2018;78(5):481-492. doi:10.1055/a-0603-4350
13. Couch F J, Shimelis H, Hu C. Associations Between Cancer Predisposition Testing Panel Genes and Breast Cancer. JAMA Oncol 2017;3:1190–1196.
14. Antoniou AC, Casadei S, Heikkinen T, Barrowdale D, Pylkäs K, Roberts J, et al. Breast-cancer risk in families with mutations in PALB2. N Engl J Med. 2014 Aug 7;371(6):497-506. doi: 10.1056/ NEJMoa1400382. PMID: 25099575; PMCID: PMC4157599.
15. Lynda Wyld, Christos Markopoulos, Marjut LeideniusE, lżbieta Senkus-Konefka Breast cancer management for surgeons.
16. Paluch-Shimon S, Cardoso F, Sessa C, Balmana J, Cardoso MJ, Gilbert F, et al. Prevention and screening in BRCA mutation carriers and other breast/ovarian hereditary cancer syndromes: ESMO clinical practice guidelines for cancer prevention and screening. Annals of Oncology. 2016;27.
17. NCCN guidelines for genetic/familial high risk assesment: Breast, Ovarian and Pancreatic.Version 1.2021. September 8, 2020
18. Cui R, Wang Y, Li Y, Li Y. Clinical value of ROMA index in diagnosis of ovarian cancer: meta- analysis. Cancer Manag Res. 2019;11:2545-2551. Published 2019 Mar 28. doi:10.2147/CMAR.S199400
19. Hartmann LC, Sellers TA, Schaid DJ, Frank TS, Soderberg CL, Sitta DL, et al. Efficacy of bilateral prophylactic mastectomy in BRCA1 and BRCA2 gene mutation carriers. Journal of the National Cancer Institute. 2001;93(21).
20. Li X, You R, Wang X, Liu C, Xu Z, Zhou J, et al. Effectiveness of prophylactic surgeries in BRCA1 or BRCA2 mutation carriers: A meta-analysis and systematic review. Clinical Cancer Research. 2016;22(15).
21. Jakub JW, Peled AW, Gray RJ, Greenup RA, Kiluk J v., Sacchini V, et al. Oncologic safety of prophylactic nipple-sparing mastectomy in a population with BRCA mutations: A multiinstitutional study. JAMA Surgery. 2018;153(2).
22. Kauff ND, Satagopan JM, Robson ME, Scheuer L, Hensley M, Hudis CA, et al. Risk-Reducing Salpingo-oophorectomy in Women with a BRCA1 or BRCA2 Mutation . New England Journal of Medicine. 2002;346(21).
23. Montemorano L, Lightfoot MD, Bixel K. Role of Olaparib as Maintenance Treatment for Ovarian Cancer: The Evidence to Date. Onco Targets Ther. 2019;12:11497-11506. Published 2019 Dec 27. doi:10.2147/OTT.S195552
24. Banerjee S, Moore KN, Colombo N, Scambia G, Kim BG, Oaknin A, et al. Maintenance olaparib for patients with newly diagnosed advanced ovarian cancer and a BRCA mutation (SOLO1/GOG 3004): 5-year follow-up of a randomised, doubleblind, placebo-controlled, phase 3 trial. Lancet Oncol. 2021 Dec;22(12):1721-1731. doi: 10.1016/S1470-2045(21)00531-3. Epub 2021 Oct 26. Erratum in: Lancet Oncol. 2021 Dec;22(12):e539. PMID: 34715071.
25. Robson M, Im SA, Senkus E, Xu B, Domchek SM, Masuda N, Delaloge S, et al. Olaparib for Metastatic Breast Cancer in Patients with a Germline BRCA Mutation. N Engl J Med. 2017 Aug 10;377(6):523-533. doi: 10.1056/NEJMoa1706450. Epub 2017 Jun 4. Erratum in: N Engl J Med. 2017 Oct 26;377(17):1700. PMID: 28578601.
26. Tutt ANJ, Garber JE, Kaufman B, Viale G, Fumagalli D, Rastogi P, et al. OlympiA Clinical Trial Steering Committee and Investigators. Adjuvant Olaparib for Patients with BRCA1-or BRCA2-Mutated Breast Cancer. N Engl J Med. 2021 Jun 24;384(25):2394-2405. doi: 10.1056/NEJMoa2105215. Epub 2021 Jun 3. PMID: 34081848.