Мариела Василева-Славева (Сдружение „Жените в онкологията“); Христина Ивановска-Пенева (Клиника по лъчелечение, СБАЛОЗ “д-р Марко Марков” Варна); Свилен Маслянков (Клиника по хирургия „ Проф. Александър Станишев“, Университетска болница Александровска); Ангел Йорданов (Катедра по акушерски грижи, Медицински Университет Плевен)
Резюме:
Подходите в лечението на метастатичния карцином на гърдата (КГ) се развиват изключително бързо в последните години, особено след въвеждането в практиката на CDK4/6 инхибиторите. До скоро препоръчителната първа линия на лечение при болни с хормон-рецептор позитивен и HER2 негативен (HR+HER2-) метастатичен КГ –комбинацията на CDK4/6 с ендокринна терапия (ЕТ), e вече заложена като стандарт за лечение в препоръките за терапевтично поведение на Европейската асоциация по медицинска онкология (ESMO), публикувани през октомври2021 г. Това е естествен завършек на много проучвания, доказващи ефективността на тази комбинация по отношениена преживяемостта без болест (ПББ) и общата преживяемост (ОП). Постигането на дългосрочна ремисия при пациентите би разширило възможностите за прилагане и на радикално оперативно лечение.
Къде сме ние?
Данните от Националния раков регистър (НРР) за 2020 г. показват, че едва 4% от болните с HR+HER2- тумори са започнали лечението си с ЕТ. От една страна, тези резулалти са шокиращо ниски, а от друга, данните от НРР са често непълни и много центрове не изпращат регулярно данни на своите пациенти за регистрация в НРР. Това още повече намалява възможностите ни да оценим проблемите в лечението на пациентите с метастатичен КГ, при които преживяемостта в България е значително по-ниска от постигната в други страни.
Real world data
България е една от малкото страни в Източна Европа, в която има раков регистър. В последните години данните от регистъра стават все по-оскъдни (1), като сякаш цели центрове изобщо не подават регулярно информация към регистъра или пък подадената информация е много оскъдна. Това прави възможностите за анализ на данните много ограничени и ясно демонстрира недостатъците на реалните пациентски данни. При средно от около 4000 нови случая на пациенти с карцином на гърдата (КГ) в последните години, за 2020 г. в НРР се намират едва 2709 регистрирани пациенти. От тях 203 (7,5%) са мъже и жени, диагностицирани в метастатичен стадиий – de novo метастатични.
Днес знаем, че основно значение за лечението на КГ има туморната биология. Терапията при пациенти с КГ се определя и от рецепторния статус, което може да раздели пациентите на няколко групи:
1. позитивни за хормонални рецептори и негативни за HER2 (HR+HER2-);
2. позитивни за хормонални рецептори и за HER2 (HR+HER2+);
3. негативни за хормонални рецептори и позитивни за HER2 (HR-HER2+);
4. негативни за хормонални рецептори и за HER2 (тройно-негативни тумори, HR-HER2-).
Информация за рецепторния статус се открива в НРР за 120 (59%) от de novo метастатичните пациенти.
Разпределението им по групи е представено на таблица 1.
| Рецепторен статус | n | % |
| Пациенти с известен рецепторен статус | 120 | 100 |
| HR+HER2- | 79 | 65.8 |
| HR+HER2+ | 22 | 18.3 |
| HR-HER2+ | 9 | 7.5 |
| HR-HER2- | 10 | 8.3 |
Таблица 1. Разпределение на de novo метастатичните пациенти според субтипове, определени от рецепторния статус
Тъй като НРР не събира данни за последния маркер, необходим за разделянето на туморите според молекулярната класификация (2, 3), а именно – пролиферативния индекс Ki-67, не можем да приложим тази класификация върху пациентите от НРР.
Пътят на пациентите с тумори, позитивни за хормонални рецептори и негативни за HER2, според данни на НРР за 2020 е представен на фигура 1.
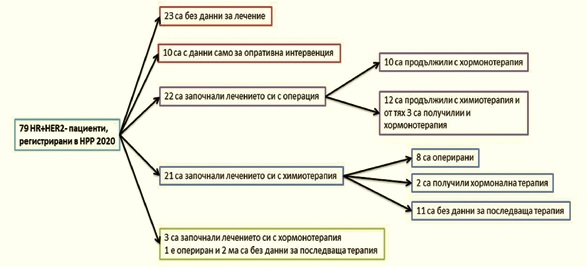
От тази фигура са видни две неща:
1) много центрове не изпращат данни за лечението на пациентите си, поради което дори, ако прилагат съвременни подходи в лечението на КГ, това не може да се установи;
2) все още голяма част от пациентите започват лечението си в метастатичен стадий с оперативна интервенция, а немалка част от HR+HER2- пациентите – с химиотерапия.
Значението на радикалната операция при пациенти с метастатичен КГ
Докато препоръките за лечение на ранен карцином все още не могат да изключат оперативното лечение като част от лечебната стратегия при КГ и прочувания към момента дават ясни насоки за поведение (4), съвсем друга е ситуацията при метастатичните карциноми.
Метаанализ, публикуван през 2012 г. и обхващащ 15 ретроспективни проучвания, установява полза за преживяемостта от извършването на операция на първичния тумор – особено когато са приложени повече терапевтични модалности (системна терапия, лъчетерапия, хирургия). Ползите са ограничени до популации с по-малко хормон-позитивни тумори (5). Тъй като проучванията по темата са в по-голямата си част ретроспективни, това повдига въпроса за определени пристрастия в селекцията на пациентите – вероятно в по-добро общо състояние и по-малко локализации на метастазите. Затова през 2018 г. се публикува и един системен обзор на 3 рандомизирани контролирани проучвания и метаанализ на 30 обсервационни проучвания (6). Едно от рандомизираните проучвания се прекратява по-рано и не открива полза за общата преживяемост (ОП) от провеждането на операция (7), друго показва полза за ОП при проследяване на пациентите повече от 40 месеца, а третото не установява разлика в преживяемостта между оперираните и неоперираните пациенти (8). Резултатите от метаанализа на обсервационните проучвания са в полза на провеждането на операция при пациенти с една метастатична локализация, само костни метастази и чисти резекционни линии (6). Тези резултати оставят място за дискусия и препоръките на Европейската асоциация по медицинска онкология за лечение на авансирал и метастатичен КГ от 2018 г. (9) и 2020 г. (10) подкрепят извършването на радикална операция само при пациентите единствено с костни метастази, и то ако е със същото внимание към детайлите, както при ранните карциноми.
Пациентите с олигометастатична болест, които са силно чувствителни на системна терапия, могат да постигнат пълна ремисися и да имат дълга преживяемост. При тях следва да се обмисли мултимодално лечение, включително с локорегионален (хирургичен) радикален подход. В този смисъл ефективната системна терапия увеличава възможностите за приложение на хирургично лечение. Провеждането на „палиативни мастектомии“ се запазва само за пациенти, при които това би подобрило значително качеството на живот (10).
Олигометастатичната болест и значението на радиотерапията
Олигометастатична болест от лъчетерапевтична гледна точка се разглежда като разпространение на болестта с не повече от пет далечни метастази (11-13). Стереотактичната радиотерапия (краниална и екстракраниална) е неинвазивен начин за лечение на олигометастатичната болест при много тумори, включително и карцином на гърдата (14-17). SABR-COMET е фаза 2 рандомизирано проучване, което доказва, че радиохирургията води както до продължителен период без прогресия на болестта, така и до увеличаване на ОП (18).
Подборът на подходящите пациенти трябва да бъде много индивидуализиран, като най-подходящи пациенти са млади жени, в добро общо състояние и ограничено разпространение на болестта (19). Положителен прогностичен маркер е също наличието само на костни метастази в сравнение с чернодробни и белодробни метастази (12).
Интересен е въпросът дали радиохирургията може да доведе до т.нар „abscopal effect“ (20). Дали лечението на една лезия с радиотерапия би могло да доведе до повишаване на имунния отговор срещу тумора и намаляване и на другите необлъчени лезии? Muraro и сътрудници докладват, че радиохирургия при олигометастатичен карцином на гърдата може да доведе до увеличение на CD4+ и CD8+ T-клетъчен отговор срещу туморните клетки (21). Този ефект в момента се проучва активно.
Системен подход в лечението на метастатичен карцином на гърдата
Системната терапия е основен подход в лечението на метатстичния КГ. При тумори с агресивна биология (HER2 преекспресиращи и тройно-негативни) системната терапия заема все по-основна роля и при ранните карциноми (22). Доказано е, че постигането на пълен патологичен отговор (ППО) след системна терапия е фактор, свързан с по-добра прогноза (23), а нивата на постигане на ППО, дори и сред пациенти извън клинични проучвания, е между 25 и 38% (24). Огромно впечатление прави едно проучване с данни от раковия регистър на Нидерландия, публикувано през 2020 г. В него се докладват нивата на ППО при 4084 пациентки, лекувани между 2010 и 2016 г. с неоадювантна терапия и впоследствие оперирани. Пациентките са получили неоадювантна системна терапия (химиотерапия, а при HER2+ тумори – и таргетна терапия), а нивата на ППО са както следва (25):
• HR+HER2- 8,9%
• HR+HER2+ 40,3%
• HR-HER2+ 68,4%
• HR-HER2- 36,8%
Видно е, че при хормон-рецептор позитивните и HER2 негативните тумори нивата на пълен патологичен отговор са в пъти по-ниски и ППО е достигнато при едва 208 (9%) от 2336 болни. Това налага търсенето на по-ефективни подходи в лечението на тази група болни.
Ендокринната терапия (ЕТ) се развива много в последните години – от първоначалното самостоятелно приложение на tamoxifen, през ароматазните инхибитори, fulvestrant, до комбинираните режими на fulvestrant и ароматазни инхибитори, на CDK4/6 и ароматазни инхибитори и на CDK4/6 и fulvestrant. През 2020 г. се публикуват ревю и метаанализ, разглеждащ 32 рандомизирани контролни проучвания и 5200 пациенти. Той сравнява различните подходи в ЕТ при авансиралия КГ. Резултатите от този анализ показват като най-ефективна комбинацията от CDK4/6 инхибитори и fulvestrant по отношение на преживяемостта без болест (ПББ) както сред резистентните, така сред чувствителните на хормонална терапия пациенти с HR+HER2- тумори. Особено ефективна е тази комбинация при de novo метастатичните пациенти и тези само с костни метастази сред ендокринно чувствителните тумори. Втората най-ефективна комбинация е CDK4/6 инхибитори + ароматазни инхибитори ± goserelin при чувствителните на ендокринна терапия и capivasertib + fulvestrant при резистентните на ЕТ(26).
Понастоящем одобрените от FDA (Агенцията за контрол на храните и лекарствата на САЩ, Food and Drug Administration) и EMA (Европейска агенция по лекарствата, European Medicines Agency) CDK4/6 инхибитори – abemaciclib, palbociclib и ribociclib, не са сравнявани директно в проучване едно спрямо друго. Смята се, че ефективността им по отношение на общата преживяемост е сходна (27, 28), а разлика може да се търси в профилите за токсичност като например по-малко неутропения и по-често диария при прилагането на abemacilib, по-малко хепатотоксичност при прилагането на palbociclib и удължаване на QT интервала при лечение с ribociclib.
Kомбинация на CDK4/6 инхибитор и fulvestrant е тествана в проучванията PALOMA-3 (palbociclib + fulvestrant 500 mg спрямо fulvestrant 500 mg) (29), MONARH 2 (abemaciclib + fulvestrant 500 mg спрямо Fulvestrant 500mg) (30) и MONALEESA 3 (ribociclib + fulvestrant 500 mg спрямо fulvestrant 500 mg) (31). И трите проучвания включват пациенти прогресирали на предишна линия ЕT. Всички те показват подобрение в ПББ, а MONALEESA-3 и MONARH-2 показват и значимо подобрение на ОП. Проучването PALOMA 3 е единственото, което включва пациенти, прогресирали на повече от една линия ЕТ (32), поради което най-вероятно и разликата в ОП не достига статистическа значимост.
Общо 5 проучвания (PALOMA-2 (33), MONALEESA-2 (34), MONALEESA-3 (32), MONARCH-3 (35) MONA MONALEESA-7 (36) оценяват ролята на CDK4/6 инхибиторите при de novo метастатичните пациенти. Всички те показват подобрение на ПББ, а тези, при които е докладвана ОП, откриват подобрение и в нея (32).
Приложението на рalbociclib при пациенти само с костни метастази значително подобрява ПББ в проучването PALOMA 2 – 36 спрямо 11,2 месеца, в PALOMA 3 14,3 спрямо 9,2 месеца. Поради което и рalbociclib може да бъде предпочитан при пациенти с единствено костни метастази, което е и най-честата локализация на далечни разпространение на болестта. Palbociclib подобрява и ПББ при болни с висцерални метастази, макар ефектът да е по-малък от наблюдавания при болните с костните метастази (37).
До 2020 г. европейските (9) и американски (38) препоръки за лечение на HR+HER2- пациенти с локално авансирал и метастатичен карцином на гърдата представят ендокринната терапия като предпочитан метод за лечение хормон-позитивна болест, дори и в присъствието на висцерални метастази, освен в случаите, когато става дума за висцерална криза или доказана ендокринна резистентност. Препоръката се допълва и от становище относно пременопаузалните пациентки, при които след постигане на супресия на овариалната функция лечението следва да се прилага по същия начин, както и при постменопаузалните жени. През октомври 2021 г. ESMO публикува и самостоятелни препоръки за диагностика и лечение на метастатичен КГ. В тях комбинацията между ЕТ и CDK4/6 инхибиторите е заложена като стандарт за първа линия лечение на HR+HER2- метастатичен КГ, тъй като подобряват ПББ и ОП при добра поносимост, подобен или дори по-добър ефект от прилагането на химиотерапия, при по-ниска токсичност, като единствено изключение е непосредствената органна недостатъчност или висцералната криза.
Понятието за висцерална криза е дефинирано особено детайлно в препоръките на Европейската асоциация по медицинска онкология (ESMO) от 2020 г. като наличие на тежка органна недостатъчност, оценена с белези и симптоми от лабораторните изследвания и бърза прогресия на болестта. Висцералната криза не е просто наличие на висцерални метастази, а включва страдание на органа, при което е необходимо прилагането на най-бързо действаща и ефикасна терапия. Пример за чернодробна висцерална криза е покачване на билирубина в отсъствие на синдром на Жилбер или обструкция на жлъчните пътища. Белодробна висцерална криза би било бързо увеличаваща се диспнея в покой, неповлияваща се от дренаж на плевралния излив и т. н. (10).
През 2021 г. на конгреса на Американската асоциация по клинична онкология (ASCO) беше представен и доклад, включващ реални пациентски данни от приложението на комбинирана терапия с CDK4/6 инхибитори при пациенти с метастатичен КГ при наличие или отсъствие на висцерална криза. Сред пациентите, получили CDK 4/6 инхибитори като първа линия на лечение спрямо друга първа линия, медианата на ОП е с 18 месеца по-голяма. Сред пациентите с висцерална криза приложението на CDK4/6 инхибитори като част от лечението подобрява медианата на ОП с 5 месеца (39).
Заключение
България е на едно от последните места в Европа по преживяемост от онкологични заболявания, в това число и от КГ (40). В последните години, с въвеждането на нови подходи в лечението, разработването на нови медикаменти, прецизиране на оперативните и локални техники и интервенции, преживяемостта от КГ нараства дори и в метастатичен стадий (41). В България има възможност за прилагане на по-голямата част от тези съвременни подходи. Имаме възможност и пряко да наблюдаваме ефектите от приложените подходи, при оптимизиране на дейността на НРР. Нужно е малко, за да можем да постигнем много.
Библиография:
1. Bulgarian National Cancer Registry. Cancer Incidence in Bulgaria, 2016 & 2017. 2020; XXVI.
2. Goldhirsch A, Wood WC, Coates AS, Gelber RD, Thürlimann B, Senn HJ. Strategies for subtypes-dealing with the diversity of breast cancer: Highlights of the St Gallen international expert consensus on the primary therapy of early breast cancer 2011. Ann Oncol [Internet]. 2011 Aug 1 [cited 2021 Jun 20]; 22 (8): 1736–47. Available from: /pmc/articles/PMC3144634/
3. Esposito A, Criscitiello C, Curigliano G. Highlights from the 14th St Gallen International Breast Cancer Conference 2015 in Vienna: Dealing with classification, prognostication, and prediction refinement to personalize the treatment of patients with early breast cancer. In: ecancermedicalscience [Internet]. ecancer Global Foundation; 2015 [cited 2021 Jul 4]. Available from: /pmc/articles/PMC4404037/
4. A S, V O, S O, H K, M M, A I, et al. Randomized Trial Comparing Resection of Primary Tumor with No Surgery in Stage IV Breast Cancer at Presentation: Protocol MF07-01. Ann Surg Oncol [Internet]. 2018 Oct 1 [cited 2021 Oct 21]; 25 (11): 3141–9. Available from: https://pubmed.ncbi.nlm.nih.gov/29777404/
5. Petrelli F, Barni S, Petrelli F, Barni ÁS. Surgery of primary tumors in stage IV breast cancer: an updated meta-analysis of published studies with meta-regression. Med Oncol. 2012; 29: 3282–90.
6. W X, Y Z, S Z, X H, P L, X X, et al. Primary tumor resection in stage IV breast cancer: A systematic review and meta-analysis. Eur J Surg Oncol [Internet]. 2018 Oct 1 [cited 2021 Oct 21]; 44 (10): 1504–12. Available from: https://pubmed.ncbi.nlm.nih.gov/30146252/
7. F F, V B-R, M K, G S, M H, M B, et al. Impact of Breast Surgery in Primary Metastasized Breast Cancer: Outcomes of the Prospective Randomized Phase III ABCSG-28 POSYTIVE Trial. Ann Surg [Internet]. 2019 Jun 1 [cited 2021 Oct 21]; 269 (6): 1163–9. Available from: https://pubmed.ncbi.nlm.nih.gov/31082916/
8. R B, R H, N N, R K, V P, S S, et al. Locoregional treatment versus no treatment of the primary tumour in metastatic breast cancer: an open-label randomised controlled trial. Lancet Oncol [Internet]. 2015 [cited 2021 Oct 21]; 16 (13): 1380–8. Available from: https://pubmed.ncbi.nlm.nih.gov/26363985/
9. F C, E S, A C, E P, M A, F A, et al. 4th ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 4)†. Ann Oncol Off J Eur Soc Med Oncol [Internet]. 2018 Aug 1 [cited 2021 Oct 21]; 29 (8): 1634–57. Available from: https://pubmed.ncbi.nlm.nih.gov/30032243/
10. Cardoso F, Paluch-Shimon S, Senkus E, Curigliano G, Aapro MS, André F, et al. 5th ESO-ESMO international consensus guidelines for advanced breast cancer (ABC 5). Ann Oncol [Internet]. 2020 Dec 1 [cited 2021 Oct 11];31(12):1623. Available from: /pmc/articles/PMC7510449/
11. Тrovo M, Furlan C, Polesel J, Fiorica F, Arcangeli S, Giaj-Levra N, et al. Radical radiation therapy for oligometastatic breast cancer: results of a prospective phase II trial. Radiother Oncol. (2018) 126:177–80. doi: 10.1016/j.radonc.2017.08.03
12. Milano MT, Katz AW, Zhang H, Huggins CF, Aujla KS, Okunieff P. Oligometastatic breast cancer treated with hypofractionated stereotactic radiotherapy: some patients survive longer than a decade. Radiother Oncol. (2019) 131:45–51. doi: 10.1016/j. radonc.2018.11.022
13. Onal C, Guler OC, Yildirim BA. Treatment outcomes of breast cancer liver metastasis treated with stereotactic body radiotherapy. Breast. (2018) 42:150–6. doi: 10.1016/j. breast.2018.09.006
14. Hong JC, Salama JK. The expanding role of stereotactic body radiation therapy in oligometastatic solid tumors: what do we know and where are we going? Cancer Treat Rev. (2017) 52:22–32. doi: 10.1016/j.ctrv.2016.11.003
15. Rieber J, Streblow J, Uhlmann L, Flentje M, Duma M, ErnstI, et al. Stereotactic body radiotherapy (SBRT) for medically inoperable lung metastases—a pooled analysis of the German working group „stereotactic radiotherapy“. Lung Cancer. (2016) 97:51–8. doi: 10.1016/j.lungcan.2016.04.012
16. Sterzing F, Brunner TB, Ernst I, Baus WW, Greve B, Herfarth K, et al. Stereotactic body radiotherapy for liver tumors: principles and practical guidelines of the DEGRO Working Group on Stereotactic Radiotherapy. Strahlenther Onkol. (2014) 190:872–81. doi: 10.1007/s00066-014-0714-1
17. Andratschke N, Alheid H, Allgäuer M, Becker G, Blanck O, Boda-Heggemann J, et al. The SBRT database initiative of the German Society for Radiation Oncology (DEGRO): patterns of care and outcome analysis of stereotactic body radiotherapy (SBRT) for liver oligometastases in 474 patients with 623 metastases. BMC Cancer. (2018) 18:283. doi: 10.1186/s12885-018-4191-2
18. Palma DA, Olson R, Harrow S, Gaede S, Louie AV, Haasbeek C, et al. Stereotactic ablative radiotherapy versus standard of care palliative treatment in patients with oligometastatic cancers (SABR-COMET): a randomised, phase 2, openlabel trial. Lancet. (2019) 393:2051–8. doi: 10.1016/S0140-6736(18)32487-5
19. Kwapisz D. Oligometastatic breast cancer. Breast Cancer. (2019) 26:138–46. doi: 10.1007/s12282-018-0921-1PubMed Abstract | CrossRef Full Text | Google Scholar
20. Dagoglu N, Karaman S, Caglar HB, Oral EN. Abscopal effect of radiotherapy in the immunotherapy era: systematic review of reported cases. Cureus. (2019) 11:e4103. doi: 10.7759/cureus.4103
21. Muraro E, Furlan C, Avanzo M, Martorelli D, Comaro E, Rizzo A, et al. Local high-dose radiotherapy induces systemic immunomodulating effects of potential therapeutic relevance in oligometastatic breast cancer. Front Immunol. (2017) 8:1476. doi: 10.3389/fimmu.2017.01476
22. Cardoso F, Kyriakides S, Ohno S, Penault-Llorca F, Poortmans P, Rubio IT, et al. Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up †. 2019;
23. Guarneri V, Broglio K, Kau S-W, Cristofanilli M, Buzdar AU, Valero V, et al. Prognostic Value of Pathologic Complete Response After Primary Chemotherapy in Relation to Hormone Receptor Status and Other Factors. https://doi.org/101200/JCO2005026914. 2016 Sep 21;24(7):1037–44.
24. Kovac A, Cankar K, Dobovisek L, Cavka L, Godina E, Horvat VJ, et al. 207P 10-year real-world outcomes with neoadjuvant systemic therapy in non-inflammatory breast cancer. Ann Oncol [Internet]. 2020 Sep 1 [cited 2021 Oct 21];31:S324–5. Available from: http://www.annalsofoncology.org/article/S0923753420403254/fulltext
25. Samiei S, Van Nijnatten TJA, De Munck L, Keymeulen KBMI, Simons JM, Kooreman LFS, et al. Correlation between Pathologic Complete Response in the Breast and Absence of Axillary Lymph Node Metastases after Neoadjuvant Systemic Therapy. Ann Surg [Internet]. 2020 Mar 1 [cited 2021 Oct 21];271(3):574–80. Available from: https://journals.lww.com/annalsofsurgery/Fulltext/2020/03000/Correlation_Between_Pathologic_Complete_Response.25.aspx
26. Brandão M, Maurer C, Ziegelmann PK, Pondé NF, Ferreira A, Martel S, et al. Endocrine therapy-based treatments in hormone receptor-positive/HER2-negative advanced breast cancer: systematic review and network meta-analysis. San Antonio Breast Cancer Symp [Internet]. 2020 [cited 2021 Oct 21];5:842. Available from: http://dx.doi.org/10.1136/esmoopen-2020-000842
27. Petrelli F, Ghidini A, Amoroso V, Berruti A. Comparative efficacy of palbociclib, ribociclib and abemaciclib for ER+ metastatic breast cancer: an adjusted indirect analysis of randomized controlled trials Treatment of hepatic metastases by colorectal cancer View project. [cited 2021 Oct 21]; Available from: https://doi.org/10.1007/s10549-019-05133-y
28. Rugo HS, Haltner A, Zhan L, Tran A, Bananis E, Hooper B, et al. Matching-adjusted indirect comparison of palbociclib versus ribociclib and abemaciclib in hormone receptor-positive/HER2- negative advanced breast cancer. https://doi.org/102217/cer-2020-0272 [Internet]. 2021 Feb 25 [cited 2021 Oct
21];10(6):457–67. Available from: https://www.futuremedicine.com/doi/abs/10.2217/cer-2020-0272
29. Turner NC, Slamon DJ, Ro J, Bondarenko I, Im S-A, Masuda N, et al. Overall Survival with Palbociclib and Fulvestrant in Advanced Breast Cancer. https://doi.org/101056/ NEJMoa1810527 [Internet]. 2018 Oct 20 [cited 2021 Oct 21];379(20):1926–36. Available from: https://www.nejm.org/doi/full/10.1056/nejmoa1810527
30. GW S, M T, P N, J S, K I, X P, et al. MONARCH 2: Abemaciclib in Combination With Fulvestrant in Women With HR+/HER2- Advanced Breast Cancer Who Had Progressed While Receiving Endocrine Therapy. J Clin Oncol [Internet]. 2017 Sep 1 [cited 2021 Oct 21];35(25):2875–84. Available from: https://pubmed.ncbi.nlm.nih.gov/28580882/
31. Slamon DJ, Neven P, Chia SKL, Jerusalem GHM, Laurentiis M De, Im S-A, et al. Updated overall survival (OS) results from the phase III MONALEESA-3 trial of postmenopausal patients (pts) with HR+/HER2- advanced breast cancer (ABC) treated with fulvestrant (FUL) ± ribociclib (RIB). https://doi.org/101200/JCO20213915_suppl1001. 2021 May 28;39(15_suppl):1001–1001.
32. George MA, Qureshi S, Omene C, Toppmeyer DL, Ganesan S. Clinical and Pharmacologic Differences of CDK4/6 Inhibitors in Breast Cancer. Front Oncol. 2021 Jul 12;0:2471.
33. Finn RS, Martin M, Rugo HS, Jones S, Im S-A, Gelmon K, et al. Palbociclib and Letrozole in Advanced Breast Cancer. https://doi.org/101056/NEJMoa1607303 [Internet]. 2016 Nov 16 [cited 2021 Oct 22];375(20):1925–36. Available from: https://www.nejm.org/doi/full/10.1056/NEJMoa1607303
34. GN H, SM S, HA B, YS Y, GS S, S P-S, et al. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptorpositive, HER2-negative advanced breast cancer. Ann Oncol Off J Eur Soc Med Oncol [Internet]. 2018 Jul 1 [cited 2021 Oct 22];29(7):1541–7. Available from: https://pubmed.ncbi.nlm.nih.gov/29718092/
35. Johnston S, Martin M, Leo A Di, Im S-A, Awada A, Forrester T, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer [Internet]. 2019 Dec 1 [cited 2021 Oct 22];5(1). Available from: /pmc/articles/PMC6336880/
36. 25. SA I, YS L, A B, N H, M C, F F, et al. Overall Survival with Ribociclib plus Endocrine Therapy in Breast Cancer. N Engl J Med [Internet]. 2019 Jul 25 [cited 2021 Oct 22];381(4):307–16. Available from: https://pubmed.ncbi.nlm.nih.gov/31166679/
37. Gennari A, André F, Barrios CH, Cortés J, De Azambuja E, Demichele A, et al. Journal Pre-proof ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer †. 2021 [cited 2021 Oct 22]; Available from: https://doi.org/10.1016/j.annonc.2021.09.019
38. Abraham J, Aft R, Agnese D, Allison KH, Anderson B, Blair SL, et al. NCCN Guidelines Version 8.2021 Breast Cancer NCCN Guidelines Panel Disclosures Continue ‡ Hematology/ Hematology oncology Þ Internal medicine † Medical oncology ≠ Pathology ¥ Patient advocacy § Radiation oncology/ Radiotherapy Ÿ Reconstructive surgery ¶ Surgery/Surgical oncology * Discussion Section Writing Committee. 2021 [cited 2021 Oct 21]; Available from: https://www.nccn.
39. Dawood SS, Brzozowski K. Efficacy of CDK4/6i in the visceral crisis setting: Result from a real-world database. https://doi. org/101200/JCO20213915_suppl1047. 2021 May 28;39(15_suppl):1047–1047.
40. C A, T M, V DC, R H, M M, M N, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet (London, England) [Internet]. 2018 Mar 17 [cited 2021 Oct 22];391(10125):1023–75. Available from: https://pubmed.ncbi.nlm.nih.gov/29395269/ 41. U D, Z T, I A. Breast Cancer Statistics in the European Union: Incidence and Survival across European Countries. Breast Care (Basel) [Internet]. 2019 Dec 1 [cited 2021 Oct 22];14(6):344–53. Available from: https://pubmed.ncbi.nlm.nih.gov/31933579/