Мариела Василева-Славева (1, 2, 3), Свилен Маслянков (4), Ния Петрова (4), Васил Нанев (5),
Ангел Йорданов (6)
1-Отделение по хирургия, Медицински комплекс „Д-р Щерев“ – София
2-Научно-изследователски институт, МУ – Плевен
3-Българско дружество за борба с рака на гърдата – София
4-Катедра по хирургия, МУ – София
5-Отделение по хирургична онкология, УМБАЛ „Д-р Георги Странски“ – Плевен
6-Катедра по акушерски грижи, МУ – Плевен
Резюме: В миналото туморите, преекспресиращи рецептора за епидермален растежен фактор 2 (HER2), са се характеризирали с по-висок риск от рецидив и по-кратка преживяемост. Откриването и прилагането на моноклоналното антитяло trastuzumab променя до голяма степен прогнозата за тези пациенти и значително подобрява шансовете им за постигане на пълен патологичен отговор (ППО) и съответно по-дълга преживяемост без болест (ПББ). Въпреки това са възможни механизми за развитие на резистентност към терапията с trastuzumab, което налага развитие на блокадата на HER2 с добавянето и на друго моноклонално антитяло – pertuzumab. Комбинацията от двете антитела е още по-ефективна в постигането на ППО и подобряване на прогнозата особено при високорискови и хормон-негативни пациенти. Така в наши дни HER2 преекспресиращите тумори постигат най-високи нива на ППО, в сравнение с останалите молекулни субтипове карцином на гърдата (КГ).
Вече са разработени и комбинирани препарати (trastuzumab, pertuzumab и hyaluronidase-zzxf) за подкожно приложение, които демонстрират същата ефективност и предлагат по-удобно приложение.
Човешкият епидермален растежен фактор 2 е член на фамилията епидермални растежни фактори, има тирозин-киназна активност и съответно сигнална функция в клетката (1). Рецепторите от тази фамилия (съответно EGFR/HER1, HER2, HER3 и HER4) притежават извънклетъчен домейн за свързване с лиганди, липофилен трансмембранен домейн и вътреклетъчен тирозин-киназен домейн. Активацията на рецептора става предимно чрез лиганд-медиирана хетеро- или хомодимеризация. В случая на HER2 активацията може да сеслучи и по механизъм, независим от свързването с лиганд, когато генът HER2 е мутирал или преекспресиран (2). Димеризацията на HER2 има за резултат автофосфорилация на тирозина, намиращ се в цитоплазмения домейн на рецептора (фигура 1). В резултат на това се активират пътища на повишена пролиферация, избягване на клетъчната смърт и транслация (фигура 2).
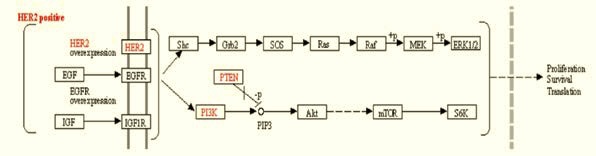
по: KEGG PATHWAY: Breast cancer + Reference pathway
Пролиферацията на клетките се промотира чрез RAS-MAPK пътя, а инхибирането на клетъчната смърт чрез mTOR пътя. AKT включва три различни ензима, всеки от които е член на протеин-киназна фамилия, инхибираща апоптозата (фигура 2).
Амплификация на HER2 се установява при около 15-30% от карциномите на гърда (КГ) (фигура 3), 10-30% от карциномите на стомаха и има прогностична и предиктивна стойност. HER2 преекспресия се установява и при други карциномни локализации като яйчници, ендометриум, пикочен мехур, бял дроб, дебело черво и глава и шия (1).
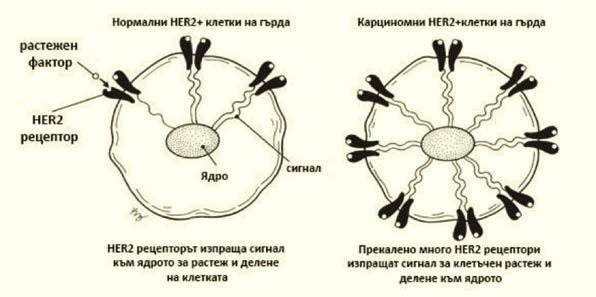
Според данни от Българския национален раков регистър HER2 преекспресиращите тумори представляват 24,2% от новодиагностицираните карциноми на гърда (5). Преекспресията на HER2 се свързва с влошена прогноза за пациентите – повишен риск от прогресия на болестта и по-кратка преживяемост (2). Trastuzumab е човешко моноклонално антитяло (IgG1), таргетиращо HER2 рецептора, като се свързва с извънклетъчния му домейн. Той е одобрен за употреба през 1998 г. Механизмът му на действие и до днес не е напълно изяснен, но е установено, че свързването му с HER2 има ефект върху хомо- и хетеродимеризацията на рецептора и съответно фосфорилацията по лиганд-зависим и независим механизъм (6). Действието му включва извънклетъчни механизми като антитяло-зависимата клетъчна цитотоксичност и вътреклетъчни механизми като апоптозата, клетъчния арест, инхибирането на ангиогенезата, възпрепятстването на механизмите за поправка на ДНК след нарушения, причинени от химиотерапията (7).
Първоначално ефектът от прилагането на trastuzumab е доказан при HER2 преекспресиращи пациентки с метастатичен карцином на гърдата. В проучване 234 пациентки са рандомизирани да получат само стандартна химиотерапия, а 235 да получат същата химиотерапия в комбинация с trastuzumab. Пациентите, които досега не са били третирани с антрациклини, са получили doxorubicin или epirubicin и cyclophosphamide със или без trastuzumab, а тези, които са били преди третирани с антрациклини, съответно само paclitaxel или paclitaxel и trastuzumab. В резултат се установява, че добавянето на trastuzumab към химиотерапията е асоциирано с по-дълго време до прогресия, по-високи нива на отговор на терапията и по-дълга продължителност на отговора; по-ниски нива на смъртност 1 година след лечението и по-дълга преживяемост (25,1 спрямо 20,3 месеца). Най-значимият страничен ефект е сърдечната дисфункция, която се е наблюдавала по-често в групата, третирана с комбинация с trastuzumab (8).
След като е доказал своята ефективност в метастатичен стадий, trastuzumab е изследван и при пациенти с ранен карцином на гърдата. В проучването HERA (The Herceptin Adjuvant) се установява, че добавянето на trastuzumab след приключване на адювантната химиотерапия значително подобрява ПББ и общата преживяемост (ОП) (9). Проучванията NSABP trial B-31 (10) и NCCTG trial N9831 изследват ефекта от приложението на една година trastuzumab след края на химиотерапията или с начало, едновременно с прилагането на paclitaxel (11). Установява се, че едновременното прилагане на trastuzumab и paclitaxel води до по-добри резултати.
Поради високата кардиотоксичност на комбинацията на trastuzumab с антрациклини се търси алтернативен и също толкова ефективен режим. Проучването BCIRG-006 сравнява:
- 1) стандартната химиотерапия с doxorubicin и cyclophosphamide, последвани от docetaxel;
- 2) същия режим в комбинация с trastuzumab за една година и с начало заедно с добавянето на docetaxel;
- 3) трети режим – docetaxel с carboplatin, давани заедно с trastuzumab, и продължаването на trastuzumab до 1 година.
Резултатите потвърждават ползата от адювантното приложение на trastuzumab и демонстрират подобна ефективност на режима без антрациклини при по-ниска токсичност и странични ефекти (12).
Следваща стъпка е прилагането на trastuzumab неоадювантно. Проучването NOAH изследва приложението на комбинация на химиотерапия с trastuzumab в сравнение с прилагането само на химиотерапия неоадювантно, като в групата с таргетна терапия приложението на trastuzumab е продължено до 1 година след операцията. Установява се, че близо два пъти повече пациенти постигат ППО в групата, лекувана с trastuzumab. Постигането на ППО е силно асоциирано с ПББ в тази група. Като цяло ПББ е по-голяма при пациенти, получили trastuzumab (13).
Пълният патологичен отговор на терапия е концепция в онкологичните проучвания, която ни позволява да оценим ефекта от лечението значително по-бързо – след края на неоадювантната терапия и съответно операцията. ППО е сурогатен маркер за ефективност на лечението, оценен по-рано от основния резултат на интерес (най-често общата преживяемост). При проучванията, изследващи пациенти с карцином на гърдата, ППО се дефинира като липса на инвазивна (+/-неинвазивна) остатъчна компонента в гърдата и лимфните възли при операцията. Постигането на ППО се свързва с подобрена прогноза само при пациентите с по-агресивни туморни типове – тройно негативни, HER2 позитивни или нискодиференцирани хормон-позитивни тумори (14).
Постигането на ППО при пациенти с HER2 позитивна болест след неоадювантно прилагане на химиотерапия и trastuzumab достига 49% (15) и дори 66,7% (16), като се свързва с по-дълга преживяемост без локална или далечна прогресия на заболяването и по-дълга обща преживяемост (15). За да се подобри още повече честотата на ППО, а с това и прогнозата на пациентите, към неоадювантната терапия за HER2 позитивни КГ се добавя още едно моноклонално антитяло – pertuzumab, с което се ограничават възможностите за поява на резистентност към trastuzumab. Pertuzumab специфично се свързва със субдомейн II на извънклетъчния домейн на HER2 и блокира свързващото пространство за димеризация на рецептора. Инхибирането на тази димеризация води до блокиране на активацията на HER2 и последващата сигнална верига (фигура 4) (17).
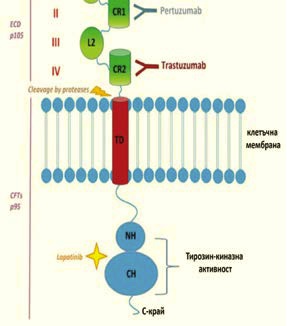
Фигура 4. Места на действие на pertuzumab
и trastuzumab в извънклетъчния домейн на
рецептора HER2
Pertuzumab е одобрен от Американската агенция за храните и лекарствата през 2012 г. за употреба в комбинация с trastuzumab и docetaxel за лечение на пациенти с метастатичен КГ. Одобрението е базирано на проучването CLEOPATRA, което доказва, че добавянето на второто моноклонално антитяло към терапията с trastuzumab значително удължава общата преживяемост на пациентите в метастатичен стадий (17). Проучването NeoSphere пък показва, че добавянето на pertuzumab към неоадювантното приложение на trastuzumab подобрява значително нивото на постигане на ППО в сравнение с други комбинации с docetaxel. Ефектът е значително по-добър при пациенти с хормон-негативни тумори в сравнение с хормон-позитивни (18). Понастоящем препоръките на Европейската асоциация по медицинска онкология (European Society for Medical Oncology, ESMO) за лечение на ранен карцином на гърда препоръчват неоадювантното приложение на комбинацията на trastuzumab и pertuzumab като валидна алтернатива при високорискови пациенти (19).
След постигане на оптимални резултати от комбинираната терапия се търсят и варианти за деескалация на терапията. Такова е проспективното мултицентрично фаза 2 проучване WSG-ADAPT-HR-/HER2+, резултатите от което са представени на конгреса на Американската асоциация по клинична онкология (American Society оf Clinical Oncology, ASCO) през 2021 г. Пациенти с ранен карцином на гърда, хормон негативни и HER2 позитивни тумори cT1-cT4c, cN0-3 (n = 134) са рандомизирани да получат четири курса trastuzumab и pertuzumab със или без paclitaxel. Първична крайна точка на проучването е ППО (ypT0/is/ypN0), като по тази причина то е спряно по-рано заради значително по-ниските нива на ППО в групата с тройна комбинация. Вторични крайни точки на проучването са ПББ и ОП на петата година от диагнозата. Проучването не установява разлика в ПББ и ОП между двата режима, но постигането на ППО след 12 седмици (независимо от приложения режим) е значително свързано с подобрена преживяемост без инвазивна болест (98,5% спрямо 82%). От 69 пациенти, при които е постигнат ППО, 39 не са получили последваща химиотерапия и в тази група е наблюдаван само един рецидив. В групата пациенти, получили само двойната комбинация на trastuzumab и pertuzumab, ППО не е постигнат при нито един пациент с ниска експресия на HER2. Това проучване за първи път показва отличните резултати по отношение на ППО и преживяемостта на пациенти, лекувани с trastuzumab, pertuzumab и paclitaxel, независимо от прилагането на адювантна химиотерапия след това. Ранното постигане на ППО след само 12 седмици е клиничен маркер за по-добра прогноза (20).
През юни 2020 г. Американската агенция по храните и лекарствата одобрява комбинираната форма за подкожно приложение на pertuzumab, trastuzumab и hyaluronidase-zzxf за лечение на HER2 позитивни ранни и метастатични КГ. Функцията на hyaluronidase-zzxf е да подобри усвояването на другите два медикамента. Одобрението се базира на проучването FeDeriCa (21) – рандомизирано мултицентрично проучване, сравняващо приложението на комбинираната форма с фиксирани дози на pertuzumab, trastuzumab и hyaluronidase-zzxf и химиотерапия спрямо венозното приложение на двата препарата поотделно в комбинация с химиотерапия както неоадювантно, така и адювантно при пациенти с ранен КГ. Проучването показва, че при подкожното приложение се постига не по-ниска доза на двата медиакмента, отколкото при венозното приложение, което позволява и екстраполация на резултатите при всички други индикации, за които е показана и венозната форма на приложение (22). Традиционно прилагането на trastuzumab и pertuzumab се извършва венозно, като приемът на първата доза от двата медикамента отнема около час, а впоследствие всяка следваща доза отнема 30 до 60 минути. Вече съществува по-удобен вариант на комбиниран препарат от trastuzumab, pertuzumab и хиалуронидаза за подкожно приложение, при който първата апликация отнема 8 минути, а всяка следваща – само 5 минути (23).
Заключение
Еволюцията в лечението на HER2 преекспесиращите тумори на гърдата е постоянна и ги превръща от тумори с агресивно поведение и очаквано влошена прогноза в такива с най-високи нива на ППО (24) и значително удължена ОП (25). Блокадата на HER2 рецептора при ранен КГ при терапията в метастатичен стадий вече включва приложението на комбинирана терапия с две моноклонални антитела – trastuzumab и pertuzumab. Разработени са форми за подкожно приложение с фиксирана доза, които имат същата ефективност и предлагат и по-удобно влагане.
Библиография:
- Iqbal N, Iqbal N. Human Epidermal Growth Factor Receptor 2 (HER2) in Cancers: Overexpression and Therapeutic Implications. Mol Biol Int [Internet]. 2014 Sep 7 [cited 2021 Nov 28]; 2014: 1–9. Available from: /pmc/articles/PMC4170925/
- Gajria D, Chandarlapaty S. HER2-amplified breast cancer: mechanisms of trastuzumab resistance and novel targeted therapies. Expert Rev Anticancer Ther [Internet]. 2011 Feb [cited 2022 Apr 26]; 11 (2): 263. Available from: /pmc/articles/PMC3092522/
- KEGG PATHWAY: Breast cancer + Reference pathway [Internet]. [cited 2022 Apr 26]. Available from: https://www.genome.jp/pathway/map05224
- Targeted Breast Cancer Therapy: Herceptin and Others –dummies [Internet]. [cited 2022 Apr 26]. Available from: https://www.dummies.com/article/home-auto-hobbies/fooddrink/recipes/cancer-recipes/targeted-breast-cancer-therapyherceptin-others-246325/
- (5) (PDF) МУЛТИДИСЦИПЛИНАРЕН ПОДХОД В ДИАГНОСТИКАТА И ЛЕЧЕНИЕТО НА КАРЦИНОМ НА ГЪРДАТА [Internet]. [cited 2022 Apr 26]. Available from: https://www.researchgate.net/publication/357870295_MULTIDISCIPLINAREN_PODHOD_V_DIAGNOSTIKATA_I_LECENIETO_NA_KARCINOM_NA_GRDATA
- Maadi H, Soheilifar MH, Choi WS, Moshtaghian A, Wang Z. Trastuzumab Mechanism of Action; 20 Years of Research to Unravel a Dilemma. Cancers (Basel) [Internet]. 2021 Jul 2 [cited 2022 Apr 26]; 13 (14). Available from: https://pubmed.ncbi.nlm.nih.gov/34298754/
- Mitri Z, Constantine T, O’Regan R. The HER2 Receptor in Breast Cancer: Pathophysiology, Clinical Use, and New Advances in Therapy. Chemother Res Pract [Internet]. 2012 Dec 20 [cited 2022 Apr 26]; 2012: 1–7. Available from: /pmc/articles/PMC3539433/
- Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med [Internet]. 2001 Mar 15 [cited 2022 Apr 26]; 344 (11): 783–92. Available from: https://pubmed.ncbi.nlm.nih.gov/11248153/
- Piccart-Gebhart MJ, Procter M, Leyland-Jones B, Goldhirsch A, Untch M, Smith I, et al. Trastuzumab after Adjuvant Chemotherapy in HER2-Positive Breast Cancer. N Engl J Med [Internet]. 2005 Oct 20 [cited 2022 Apr 26]; 353 (16): 1659–72. Available from: https://www.nejm.org/doi/full/10.1056/nejmoa052306
- Romond EH, Perez EA, Bryant J, Suman VJ, Geyer CE, Davidson NE, et al. Trastuzumab plus Adjuvant Chemotherapy for Operable HER2-Positive Breast Cancer. N Engl J Med [Internet]. 2005 Oct 20 [cited 2022 Apr 26]; 353 (16): 1673–84. Available from: https://www.nejm.org/doi/10.1056/NEJMoa052122
- Perez EA, Romond EH, Suman VJ, Jeong JH, Sledge G, Geyer CE, et al. Trastuzumab Plus Adjuvant Chemotherapy for Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer: Planned Joint Analysis of Overall Survival From NSABP B-31 and NCCTG N9831. J Clin Oncol [Internet]. 2014 Nov 20 [cited 2022 Apr 26]; 32 (33): 3744. Available from: /pmc/articles/PMC4226805/
- Slamon D, Eiermann W, Robert N, Pienkowski T, Martin M, Press M, et al. Adjuvant Trastuzumab in HER2-Positive Breast Cancer. http://dx.doi.org/101056/NEJMoa0910383 [Internet]. 2011 Oct 5 [cited 2022 Apr 26]; 365 (14): 1273–83. Available from: https://www.nejm.org/doi/full/10.1056/nejmoa0910383
- Gianni L, Eiermann W, Semiglazov V, Lluch A, Tjulandin S, Zambetti M, et al. Neoadjuvant and adjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer (NOAH): follow-up of a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet Oncol [Internet]. 2014 [cited 2022 Apr 26]; 15 (6): 640–7. Available from: https://pubmed.ncbi.nlm.nih.gov/24657003/
- von Minckwitz G, Fontanella C. Comprehensive Review on the Surrogate Endpoints of Efficacy Proposed or Hypothesized in the Scientific Community Today. J Natl Cancer Inst Monogr [Internet]. 2015 May 1 [cited 2022 Apr 26]; 2015 (51): 29–31. Available from: https://pubmed.ncbi.nlm.nih.gov/26063882/
- Kim MM, Allen P, Gonzalez-Angulo AM, Woodward WA, Meric-Bernstam F, Buzdar AU, et al. Pathologic complete response to neoadjuvant chemotherapy with trastuzumab predicts for improved survival in women with HER2-overexpressing breast cancer. Ann Oncol [Internet]. 2013 Aug 1 [cited 2022 Apr 26]; 24 (8): 1999–2004. Available from: http://www.annalsofoncology.org/article/S092375341936805X/fulltext
- Buzdar AU, Ibrahim NK, Francis D, Booser DJ, Thomas ES, Theriault RL, et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: Results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer. J Clin Oncol [Internet]. 2005 [cited 2021 Jul 4]; 23 (16): 3676–85. Available from: https://pubmed.ncbi.nlm.nih.gov/15738535/
- Nami B, Maadi H, Wang Z. Mechanisms Underlying the Action and Synergism of Trastuzumab and Pertuzumab in Targeting HER2-Positive Breast Cancer. Cancers (Basel) [Internet]. 2018 Oct 1 [cited 2022 Apr 26]; 10 (10). Available from: /pmc/
articles/PMC6210751/ - Gianni L, Pienkowski T, Im YH, Roman L, Tseng LM, Liu MC, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol [Internet]. 2012 Jan 1 [cited 2022 Apr 26]; 13 (1): 25–32. Available from: http://www.thelancet.com/article/S1470204511703369/fulltext
- Cardoso F, Kyriakides S, Ohno S, Penault-Llorca F, Poortmans P, Rubio IT, et al. Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up †. 2019;
- Harbeck N, Gluz O, Christgen M, Kuemmel S, Grischke E-M, Braun M, et al. De-escalated neoadjuvant pertuzumab+trastuzumab with or without paclitaxel weekly in HR-/HER2+ early breast cancer: ADAPT-HR-/HER2+ biomarker and survival results. J Clin Oncol. 2021 May 20; 39 (15_suppl): 503–503.
- Tan AR, Im SA, Mattar A, Colomer R, Stroyakovskii D, Nowecki Z, et al. Fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection plus chemotherapy in HER2-positive early breast cancer (FeDeriCa): a randomised, open-label, multicentre, non-inferiority, phase 3 study. Lancet Oncol [Internet]. 2021 Jan 1 [cited 2022 Apr 26]; 22 (1): 85–97. Available from: https://pubmed.ncbi.nlm.nih.gov/33357420/
- Gao JJ, Osgood CL, Gong Y, Zhang H, Bloomquist EW, Jiang X, et al. FDA approval summary: Pertuzumab, trastuzumab, and hyaluronidase-zzxf injection for subcutaneous use in patients with HER2-positive breast cancer. Clin Cancer Res [Internet]. 2021 Apr 1 [cited 2022 Apr 26]; 27 (8): 2126–9. Available from: https://aacrjournals.org/clincancerres/article/27/8/2126/671914/FDA-Approval-Summary-Pertuzumab-Trastuzumab-and
- Phesgo [Internet]. [cited 2022 Apr 26]. Available from: https://www.breastcancer.org/treatment/targeted-therapy/phesgo
- Samiei S, Van Nijnatten TJA, De Munck L, Keymeulen KBMI, Simons JM, Kooreman LFS, et al. Correlation between Pathologic Complete Response in the Breast and Absence of Axillary Lymph Node Metastases after Neoadjuvant Systemic Therapy. Ann Surg [Internet]. 2020 Mar 1 [cited 2021 Oct 21]; 271 (3): 574–80. Available from: https://journals.lww.com/annalsofsurgery/Fulltext/2020/03000/Correlation_Between_Pathologic_Complete_Response.25.aspx
- Vici P, Pizzuti L, Natoli C, Moscetti L, Mentuccia L, Vaccaro A, et al. Outcomes of HER2-positive early breast cancer patients in the pre-trastuzumab and trastuzumab eras: a real-world multicenter observational analysis. The RETROHER study. Breast Cancer Res Treat [Internet]. 2014 Sep 24 [cited2022 Apr 26]; 147 (3): 599. Available from: /pmc/articles/PMC4174332/